AZNALCÓLLAR
Contesta a las siguientes cuestiones:
- Dónde y cuándo se produjo este desastre ecológico.
- De qué era la mina.
- Qué residuos fueron vertidos.
- A qué afectó
- Qué actuaciones se han llevado a cabo para recuperar la zona.
Color
|
Sustancias químicas
|
Rojo
|
Li2CO3,
SrCO3,
Sr(NO3)2, SrC2O4·H2O
|
Naranja
|
CaCl2,
CaSO4·xH2O,
CaCO3
|
Dorado
|
Fe, C,
Aleación Ti-Fe
|
Amarillo
|
NaNO3, Na3AlF6, Na2C2O4,
NaHCO3,
NaCl
|
Verde
|
|
Azul
|
CuCl,
CuSO4·5H2O
|
Violeta
|
Mezcla
de compuestos de Sr (rojo) y Cu (azul)
|
Plata
|
Al, Ti,
Mg
|
Blanco
|
Al, Mg,
BaO
|
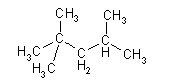 | 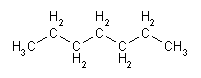 |
| isooctano(2,2,4-trimetilpentano) |
heptano
|